SEXTA REUNION DE EXPERTOS DE LA INICIATIVA INTERNACIONAL EN DENGUE. PARA LA IMPLEMENTACIÓN DE LA VACUNA CONTRA EL DENGUE EN AMERICA LATINA
INTRODUCCION
La 6th reunión de Dengue en América Latina se realizó el 22 y 23 de junio de 2018 en Lima, Perú.
En la reunión participó un grupo permanente de América Latina y otros expertos internacionales en dengue y vacunación. Incluyó una serie de conferencias, talleres y discusiones. El grupo recibió el aval de la Sociedad Latinoamericana de Infectología Pediátrica (SLIPE), Asociación Latinoamericana de Pediatría (ALAPE) y la Asociación Panamericana de Infectología (API).
El objetivo de la reunión fue actualizar el Documento de Posición de la Iniciativa Internacional contra el dengue para la vacunación contra el dengue en América Latina, basado en el nuevo prospecto del producto por parte del fabricante y las recomendaciones de Grupo Asesor Estratégico de Expertos (SAGE), así como en las discusiones sobre conceptos relevantes, la evidencia más reciente y las experiencias en los países que la han implementado.
Esta reunión incluye una serie de presentaciones, talleres y discusión. En el presente informe, se resumen las conclusiones principales y la postura del grupo.
- ANTECEDENTES
- LA ENFERMEDAD.
El dengue es considerado de acuerdo a la OMS una amenaza en la salud pública (1) la mitad de la población mundial está a riesgo y en América Latina la enfermedad viene aumentado de forma vertiginosa desde los años 80 con casi 13 millones de casos acumulados desde 2010, entre 2017 y 2018 se observa una disminución de los casos acorde con el comportamiento cíclico de la enfermedad y con la acumulación de susceptibles se espera un importante brote en la región en los años venideros. La letalidad en la región tiene un comportamiento variable. (2,3)
La carga real del dengue es subestimada con tasas de incidencia que podrían ser de 10 a 20 veces mayores de las que se informan en algunos países. (4,5,6,7,8,9, 10).
La patogenia del dengue grave no se conoce del todo, es compleja, aparentemente es el resultado de la interacción entre diferentes factores como el nivel de anticuerpos, el tipo y calidad de los mismos, la respuesta celular, el serotipo y en particular el genotipo del virus así como la edad y las características individuales del huésped. (11-22).
B.ASPECTOS CLAVES A CONSIDERAR ACERCA DE LA VACUNA CONTRA EL DENGUE.(23-28)
- Resultados estudios Fase III:
Resumen de las características de la única vacuna actualmente disponible para la prevención del dengue de acuerdo a la edad de indicación, según datos de los análisis combinados de los estudios fase III.
- Eficacia:
Contra el dengue virológicamente confirmado (DVC) : 65,6 %
Contra la enfermedad grave y hospitalización debida a DVC fue de 92,9 y 80,8 respectivamente.
Por serotipo:
- Serotipo 1: 58,4 (47,7 a 66,9)
- Serotipo 2: 47,1 (31,3 a 59,2)
- Serotipo 3: 73,6 (64,4 a 80,4)
- Serotipo 4: 83,2 (76,2 a 88,2).
Eficacia de acuerdo con el estado serológico previo
- Seropositivos: 81,9
- Seronegativos: 52,5 ( Estadísticamente significativa)
- Datos de seguimiento a largo plazo:
El R.R. de hospitalización en el seguimiento a largo plazo en un análisis combinado de los estudios fase III: 0,374 (0,30 a 0,47) en la población objetivo, independientemente del país o estado serológico previo, lo que demuestra beneficio poblacional permanente a lo largo del tiempo.
Los datos del LTFU de acuerdo con el estado serológico previo evaluado en el subgrupo inmune (2 mil sujetos en cada estudio de Fase III) no muestra aumento del riesgo de hospitalización por dengue o dengue grave en en pacientes seronegativos mayores de 9 años; pero los datos son limitados por el número de casos de hospitalización por dengue o dengue grave ocurrido en el subgrupo de inmunogenicidad, en el cual se conocía el estado inmune previo.
La comunidad científica, de salud pública y reguladora ha indicado que la seguridad de la vacuna CYD en la población seronegativa es un importante vacío del conocimiento y que la información disponible de los estudios Fase III es limitada debido al tamaño reducido del subgrupo con datos de inmunogenicidad a la línea de base.
- Análisis Post Hoc, para evaluar el efecto del estado inmune previo(26,27):
Sanofi Pasteur ha desarrollado un análisis Post hoc destinado a evaluar el funcionamiento de la CYD-TDV de acuerdo con el estado inmunológico previo. Este análisis se basa en un estudio de casos- cohorte derivado de los estudios de Fases III y IIb.
- En ausencia de muestras en la línea de base para todos los participantes de la población estudiada, se usaron las muestras del mes 13 (1 mes después de la tercera dosis), las cuales están disponibles para cada uno de los 31 000 participantes, para estimar el estado serológico de dengue pre vacunación.
- Un nueva prueba de (ELISA) de IgG contra la proteína no estructural 1 (NS1) del dengue, desarrollado recientemente, se utiliza para diferenciar los anticuerpos anti-NS1 que induce la infección de dengue de tipo silvestre, de las respuestas que induce la vacunación, ya que la CYD-TDV contiene genes que codifican para la proteína NS1 de la vacuna 17D contra la fiebre amarilla, no del virus del dengue.
- Los investigadores utilizan diferentes enfoques para definir el estado serológico (la metodología completa se describe en Sridhar et al., 2018 publicado en NEJM).
- Con el fin de evitar la clasificación errónea debida a enfermedad asintomática durante los primeros 12 meses o el efecto de la vacuna debido a la reactividad cruzada, se utilizaron dos métodos de imputación: Imputación Múltiple por regresión logística y “superaprendiz” para la estimación basada en la pérdida mínima. En el análisis principal, el estado serológico inicial se determinó con base en los títulos medidos o imputados de acuerdo a una prueba de neutralización por reducción de placas de 50 % (PRNT50).
- El porcentaje de sujetos con datos ausentes de PRNT50 en Mo fue de 66,7 %.
- Resultados principales:
- En participantes seropositivos de 9-16 años:
- En la Fase activa (hasta el mes 25), la eficacia de la vacuna fue de 76 % contra el DCV sintomático.
- El riesgo relativo después de 60 meses de seguimiento fue de 0,2 en cuanto a hospitalización y/o dengue grave, y de 0,14 para el dengue grave.
ii. En sujetos seronegativos del mismo grupo de edad:
- Los valores correspondientes fueron de 39 % (IC de 95 %: −1 a 63), 1,40 (IC de 95 %: 0,70 a 2,80) y 2,29 (IC de 95 %, 0,44 a 11,92).
- Ninguno de los datos alcanzo la significancia estadística.
- Los sujetos seronegativos vacunados presentaron menos hospitalizaciones dadas por DCV que los no vacunados hasta el mes 30; luego, la curva se cruza sobre la curva de control y se acerca lentamente a la curva de controles seropositivos durante los meses siguientes.
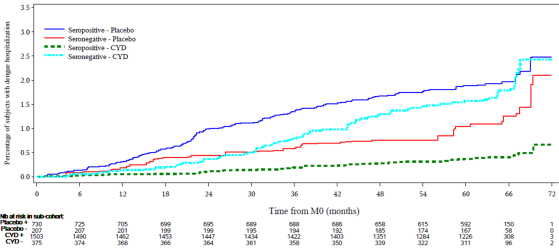
- La incidencia similar de hospitalización y Dengue grave en participantes seronegativos vacunados y seropositivos no vacunados coincide con la hipótesis de que la vacunación en individuos seronegativos provoca una infección parecida a la infección primaria.(24,25) Parece plausible que la CYD-TDV genere una respuesta inmunitaria semejante a la infección primaria de tipo silvestre en seronegativos, por lo tanto, debido a la disminución de la protección, el sujeto podría estar en el mismo riesgo de una infección secundaria de tipo silvestre, después de los 30 meses de la vacunación que los sujetos que han tenido una infección primaria natural .

Aunque un estudio de casos cohorte en un análisis post hoc es válido desde el punto de vista metodológico, el bajo poder reportado (25% para un R.R. de 1.4 , con un estimado de 72 casos, en población mayor de 9 años seronegativa) (27), las dificultades para definir basados en el mes 13 el estado serológico en la línea de base, las limitaciones propias de la imputación, este estudio podría penalizar una buena vacuna para prevenir el dengue en la población mayor de 9 años de edad.
- Implicaciones en salud pública de éstos hallazgos : (24-28)
- A nivel poblacional, hay una reducción marcada del riesgo atribuible de hospitalización y dengue grave con la vacunación de sujetos seropositivos de 9−16 años. De acuerdo con las estimaciones de riesgo atribuible a lo largo de un período de seguimiento de 5 años, para cada caso adicional en sujetos vacunados seronegativos, el número de casos de hospitalización y dengue graves prevenidos en sujetos seropositivos vacunados sería, respectivamente, de 7 y 4 en el contexto de seroprevalencia de 70 %, de 13 y 7 en el de seroprevalencia de 80 %, y de 28 y 16 en el de seroprevalencia de 90 %.
- El número necesario vacunar (NNV) es un estimativo de uso en salud pública que expresa el número de personas que se debe vacunar para evitar un caso de enfermedad.
- Efecto de prevenir un caso de hospitalización con DCV, es necesario vacunar 91 sujetos (NNV = 91), mientras que el NNV es de 400 para el dengue grave. En comparación, con la vacuna de la influenza se tiene NNV de 1850 para la hospitalización en niños y con la vacuna meningocócica MenB, NNV de 35 000 para la meningitis. Por lo tanto, el valor en salud pública de la vacuna contra el dengue, según se calcula con el NNV, es similar o aún mejor que el de otras vacunas.
- Esta vacuna, como todas las demás, debe ser evaluada en el contexto del impacto en la salud pública.
- NUEVOS DATOS DE SEGURIDAD (25,30,31)
- No hay diferencias en la incidencia de eventos adversos graves (EAG) ajenos al dengue y EAG mortales después de 5 años de seguimiento (LTFU) en sujetos del grupo de vacunados y del grupo placebo, tanto seronegativos como seropositivos.
- En relación a la experiencia post mercadeo, en un análisis de seguridad que publicó recientemente el Comité Asesor Global sobre la Seguridad de Vacunas (GACVS), se evaluaron las muertes por dengue en Filipinas y se llegó a la conclusión de que, de acuerdo con la clasificación de eventos adversos de vacunas de la OMS, la mayoría de los casos son indeterminados, coincidenciales (no relacionados) o no clasificables. No se tiene evidencia suficiente que relacione la CYD-TDV con las muertes por dengue en Filipinas.
Datos de seguridad de la vacuna contra el Dengue en Paraná, Brasil (32,33)
- En Paraná, la campaña de vacunación contra el dengue basado en las comunidades se inició en agosto de 2016. Se seleccionaron 30 municipios con base en criterios de incidencia de la enfermedad y epidemias previas. De acuerdo a la carga del dengue por edad que identificó el servicio de vigilancia del estado del Paraná la vacuna se administró a sujetos de 15 a 27 años en 28 municipios y de 9 a 45 años en dos municipios, con población objetivo total de 500.000 habitantes. Se administraron tres dosis a intervalos de 6 meses.
- En total, se administraron 639.579 dosis, con coberturas de alrededor de 60 % para la primera dosis (311.058 vacunas), 70 % (219.078 personas vacunados) para la segunda dosis y 50 % para la tercera dosis.
- Las bases de datos de vacunación (sistema de registro de vacunas) y vigilancia del dengue (Sistema de Informação de Agravos de Notificação [SINAN]) se enlazaron para comparar las personas vacunadas con los casos confirmados de dengue. Hasta 2017, en Paraná fueron vacunados 311 053 sujetos, de los cuales 47(0,01 %) tenían dengue confirmado. Ninguno de estos casos requirió hospitalización. El número total de casos de dengue confirmado que se informó en la población de Paraná fue de 1108, de los cuales 47 (4,2 %) fueron vacunados.
- Los eventos adversos después de la inmunización se notificaron por correo electrónico o directamente a la unidad de salud pública. No hay muertes relacionadas con la vacuna. Los eventos adversos fueron leves en su inmensa mayoría, y los graves no se relacionaron con la vacunación. Aunque los datos sobre el impacto de la vacuna aún no están disponibles, la incidencia de dengue disminuyó en los 30 municipios, y en los de mejor cobertura hubo menor incidencia de dengue. (32)
- PRUEBA SEROLÓGICA DEL DENGUE COMO DIAGNÓSTICO COMPLEMENTARIO PARA RESPALDAR LA IMPLEMENTACIÓN DE LA VACUNA (34)
Ha surgido la necesidad de una prueba diagnóstica que permita detectar rápidamente infecciones pasadas de dengue.
En condiciones ideales, una prueba con muy alta especificidad (≥99 %) minimizaría el riesgo individual y el uso accidental de la vacuna en personas seronegativas. Una prueba de alta sensibilidad (≥90 %) maximizaría el beneficio para la población.
Dos tipos de pruebas se podrían considerar:
- Ensayos serológicos como el ELISA de IgG del dengue
- Los test de diagnóstico rápido (TDR).basados en detección de anticuerpos contra antígenos específicos del dengue.
Los ELISA no proporcionan información en el punto de atención respecto al estado serológico individual.
Sanofi Pasteur realizó una evaluación preliminar de los test de diagnóstico rápido (TDR) y ensayos de inmunoabsorción enzimática convencionales (ELISA) para determinar la infección previa por dengue , los resultados principales son:
- Especificidad favorable > 98% para el componente IgG de RDT y ELISA.
- Sensibilidad de 40-70% para TDR y 90% para ELISA.
- La tasa de falsos positivos por Fiebre Amarilla o Encefalitis Japonesa en general es menor al 3%, especialmente para las TDR, y ELISA ( Panbio) no así para ELISA ( focus) .
- La alta especificidad de estas pruebas actualmente disponibles, a pesar de las limitaciones en sensibilidad, permite considerar el uso de las mismas en áreas endémicas, hasta que se disponga de un mejor test.(25)
- BASES DE MODELAJE PARA LA IMPLEMENTACIÓN DE LA VACUNA (35,36)
Sanofi Pasteur ha desarrollado un modelo aun no publicado, utilizando resultados de NS1, a fin de evaluar los beneficios y riesgos de la vacunación contra el dengue en diferentes contextos de transmisión y de horizontes temporales, y considerando o no la protección indirecta. ( Coudeville L et al, presentación durante el IDI)
Hipótesis principal: La vacunación imita una infección natural silenciosa y modifica las probabilidades de la enfermedad de la misma manera que la infección natural.
Consecuencias de acuerdo con el estado serológico antes de la vacunación
- Sujetos seropositivos: Beneficio a largo plazo y sostenidos
- Sujetos seronegativos: Período transitorio de riesgo por la mayor severidad de la infección secundaria; la vacunación inicia beneficios en sujetos seronegativos que tienen al menos dos infecciones.
El factor principal para la eficacia es el estado serológico inicial, y otros factores son la edad de vacunación y el serotipo.
El beneficio indirecto potencial con la vacunación incluye una mejoría en el impacto de la vacunación en seronegativos dado por la disminución del riesgo de dengue en personas no vacunadas.
Los análisis indican que la población que vive en áreas con seroprevalencia superiores al 50% antes de los 20 años de edad es de 145 a 160 millones de personas en Brasil y de 35 a 45 millones de personas en México. De manera similar, la población que vive en áreas con seroprevalencia superior al 80% antes de los 20 años de edad va de 95 a 116 millones de personas en Brasil y de 10 a 22 millones de personas en México.
La OMS considera dos abordajes de implementación de la vacuna contra el dengue:
- Estrategia basada en la seroprevalencia: Vacunación independiente del estado serológico de dengue en entornos de transmisión alta (seroprevalencia >80 % a los 9 años).
- Estrategia de test pre vacunación: Vacunación de sujetos con test pre vacunación positivo para infección previa por dengue o antecedente de caso confirmado de dengue. Esta es la opción preferencial del SAGE de la OMS.
Se evaluó el posible impacto de la vacunación contra el dengue, con y sin detección antes de la vacunación, en diversos entornos y con TDR actuales (sensibilidad del 70 % y especificidad de 99 %) u optimizadas (sensibilidad de 90 % y especificidad de 99 %).
Con la detección antes de la vacunación, el efecto depende de la sensibilidad de la prueba para detectar la exposición previa al dengue.
La detección antes de la vacunación permite la implementación de programas más grandes que tienen mayor impacto, a menos que se sepa que una gran proporción de la población vive en entornos de transmisión alta.
En entornos de transmisión moderada (50 % a los 9 años), la detección antes de la vacunación es más eficiente (y potencialmente más rentable) que un abordaje basado en la seroprevalencia, siempre que el costo de detección sea menor que el de la vacuna (<75 % de los costos de administrar una dosis de la vacuna).
En entornos de transmisión muy alta (90 % a los 9 años), la vacunación basada en la seroprevalencia sigue siendo más eficaz que la detección antes de la vacunación (a menos que las pruebas serológicas sean muy baratas, es decir, 10 % o menos de los costos de administrar una dosis de la vacuna).
En conclusión, en entornos de alta transmisión conocida (≥80 % de seroprevalencia a los 9 años), la vacunación basada en la seroprevalencia se relaciona con impacto máximo, y se espera que sea más costo- efectiva que la detección antes de la vacunación. En otros entornos o en el contexto de transmisión heterogénea, la detección antes de la vacunación permite implementar programas más amplios de vacunación y de mayor impacto en la salud, es potencialmente más costo efectivo que el abordaje basado en la seroprevalencia si las pruebas no son muy costosas y disminuye el riesgo de individuos seronegativos. Una TDR óptimo para la detección antes de la vacunación debe mejorar el impacto y la rentabilidad de los programas de vacunación contra el dengue.
II. RECOMENDACIONES DE LA INICIATIVA INTERNACIONAL CONTRA EL DENGUE (IDI).
- La enfermedad se
debe documentar en cada país y subregión, en cuanto a
- Endemicidad, (Áreas específicas donde la enfermedad ocurre de manera continua y con regularidad predecible en una población.(38) o notificación sostenida de casos de dengue durante 20 semanas o más en al menos uno de los últimos 5 años .
- Gravedad
- Carga por grupos de edad
- Cada país debe trabajar en su propio mapa de transmisión del dengue, de acuerdo con sus datos epidemiológicos (incidencia, edad de incidencia y de hospitalización, circulación de serotipos y frecuencia de brotes).
- Con el fin de definir las áreas de mayor transmisión, sería útil aplicar los criterios siguientes:
- Al menos dos epidemias de dengue durante los últimos 5 años.
- Incidencia acumulativa mayor de 500 por cada 100 000 habitantes en los últimos 5 años.
- Informes de muerte por dengue en al menos uno de los últimos años.
- Circulación concomitante de al menos dos serotipos.
- Incidencia alta de hospitalización en adolescentes.
- Actualmente, muchos países ya cuentan con mapas detallados a pequeña escala, en los que se describe la epidemiología del dengue en los últimos años, incluidos los datos de seroprevalencia. Estos mapas permiten priorizar las áreas de intervención con la vacuna que se deben comenzar tan pronto sea posible.
- Se recomienda el uso de las guías para el diseño y realización de encuestas serológicas preparado por la OMS (37)
- La vacuna es un componente importante de una estrategia integrada para la prevención y control del dengue. Es necesario continuar otras acciones preventivas, como el control de vectores, la prevención de las picaduras de mosquito, formación e información. Deben continuar las actividades de investigación relativas a las acciones de prevención.
- Las características de la transmisión del dengue en la población objetivo se deben evaluar anticipadamente, para discriminar entre la vacunación masiva o la vacunación solo de individuos seropositivos.
- En las áreas de endemicidad alta con predominio de sujetos seropositivos, el beneficio supera claramente el riesgo a nivel poblacional y los estudios de seroprevalencia o la evaluación serológica antes de la vacunación tendrían diversas limitaciones y aumentarían significativamente los costos de los programas de vacunación, con retraso de la decisión de introducir la vacuna en zonas con carga de enfermedad alta, que posiblemente se beneficiarían de los programas de vacunación.
- En las áreas con seroprevalencia alta (>80 %), las pruebas previas no añaden beneficios y disminuyen la costo efectividad de la estrategia de vacunación.
- Los países pueden iniciar la vacunación en municipios donde ya se tienen estudios de seroprevalencia y se cumple con los criterios.
- En áreas de endemicidad intermedia o baja, donde la relación beneficio-riesgo no es clara, son obligatorias las pruebas previas, para establecer los antecedentes de infección antes de la vacunación. Esta estrategia permite mejorar la cobertura de vacunación, además de generar datos de seroprevalencia que posibilitan la toma de decisiones ulterior.
- Consideraciones específicas de las pruebas previas:
- La prueba de captura de ELISA podría ser impráctica, debido al tiempo necesario para obtener los resultados y la reacción cruzada con otros flavivirus, y no se debe recomendar en países con circulación concomitante significativa de flavivirus.
- Los TDR podrían ser aplicables en el punto de atención y deben ser fáciles de usar, cualitativas, utilizar sangre completa y estar validadas para evaluar la infección por dengue previa a cualquier edad, en cualquier entorno endémico.
- La prueba ideal tiene que ser muy específica, para evitar la vacunación de sujetos seronegativos, y de sensibilidad alta, a fin de maximizar el impacto al vacunar a un número mayor de sujetos seropositivos.
- Una opción razonable sería usar la prueba con la más alta especificidad disponible actualmente y, entretanto, desarrollar pruebas de diagnóstico rápido optimizadas.
- Cuando se requiere una prueba para la confirmación del estado serológico, el consenso es no retrasar la vacunación cuando sea necesaria a la espera de la siguiente generación de TDR.
- Los países deben usar las mejores pruebas disponibles y ayudar al desarrollo de nuevas pruebas compartiendo datos epidemiológicos y muestras biológicas, además de realizar proyectos de demostración con las pruebas actuales.
- Aunque la vacuna no está indicada para la respuesta a brotes, si ayudaría a prevenir brotes.
- Cada país debe implementar una estrategia de información sólida y documentada sobre vacunación, además de la planificación óptima de los programas. Las estrategias de vacunación contra el VPH puede servir como ejemplos, y las lecciones aprendidas con la aplicación de la vacuna contra el VPH deben ayudar a la vacunación contra el dengue.
- Los países que implementen la vacuna deben contar con vigilancia sólida de eventos adversos.
- Se deben fortalecer los comités y proporcionar información adecuada a quienes estén a cargo del programa.
- La vigilancia debe incluir el número de dosis administradas, situación epidémica y factores de confusión.
- Edad:
1. Actualmente la vacuna está indicada en población mayor de 9 años.
2. La edad de implementación debe estar de acuerdo con las recomendaciones de la agencia regulatoria local.
3. La edad de vacunación para las campañas públicas debe corresponder a los grupos de edad con mayor seroprevalencia o incidencia de hospitalización.
4. La selección de grupos de edad también debe estar de acuerdo con las experiencias previas de adherencia a la vacuna.
5. Se podría extender la cohorte de vacunación para tener un mayor y más rápido impacto, el tamaño de la cohorte dependerá de la información arrojada por los modelos alimentados con datos locales.
- Los países deben tomar sus propias decisiones con base en la información de la evidencia médica y el apoyo de diversos paneles de expertos.
- Las pautas elaboradas por sociedades científicas y médicas (p. ej., SLIPE) deben recibir mayor difusión y ayudar a la toma de decisiones en el país.
- En resumen, la vacuna se debe implementar como una estrategia de salud pública y la introducción de la vacuna requiere el consenso de las sociedades científicas, autoridades de salud y de la sociedad civil para garantizar que haya un programa de comunicación adecuado.
Las recomendaciones se deben actualizar con regularidad, a medida que surja nueva evidencia científica.

